2024年7月10日,8797威尼斯老品牌朱斌教授团队在国际核酸领域权威期刊《Nucleic Acids Research》发表题为“DNA-terminus-dependent transcription by T7 RNA polymerase and its C-helix mutants”的研究论文。
论文链接:
https://academic.oup.com/nar/advance-article-abstract/doi/10.1093/nar/gkae593/7709539?utm_source=advanceaccess&utm_campaign=nar&utm_medium=email
当前生物医学已迎来了RNA时代,mRNA药物和疫苗崭露头角便引起变革,而RNA的体外合成恰是RNA研究和应用的限制瓶颈。化学合成法合成RNA的极限长度在一百个核苷酸左右,目前制备长链RNA的唯一方法是上世纪80年代Uhlenbeck等建立的体外转录,即利用天然的RNA合成机器-DNA依赖的RNA聚合酶,在体外从带有相应转录启动子序列的DNA模版上反复转录线性扩增产生所需的RNA。然而自然界绝大部分的RNA聚合酶都具有非常复杂的亚基组成和调控机制,无法用作体外标准可控高产的RNA合成工具酶,因而上世纪70年代Studier等从噬菌体T7中发现的单亚基RNA聚合酶垄断了当前的RNA体外合成技术。受限于具有单亚基RNA聚合酶的噬菌体的稀少及研究难度,自上世纪80年代以来再无其他研究团队对新型噬菌体单亚基RNA聚合酶的研究报道。而朱斌团队历时10余年建立了国际上唯一系统性发掘新型噬菌体单亚基RNA聚合酶的研究方向,报道了新世纪以来所有的新型(Syn5、KP34及VSW-3)噬菌体单亚基RNA聚合酶转录系统的功能研究及其体外转录应用,分别针对性改善了T7 RNA聚合酶的一些缺陷,其中来自云南香格里拉高原冰湖的VSW-3 RNA聚合酶独特的低温合成可显著降低mRNA中的双链RNA污染,目前已在美国以Ice lake RNA polymerase为商标投入商业化应用(ribotech.us)。但目前的mRNA合成规范已高度适配于T7 RNA聚合酶,例如转录DNA模版、帽类似物、高产反应条件等均为T7 RNA聚合酶的性质所标准化,因此短期内开发性能改进的T7 RNA聚合酶突变体将更快推动RNA研究和mRNA药物疫苗应用。
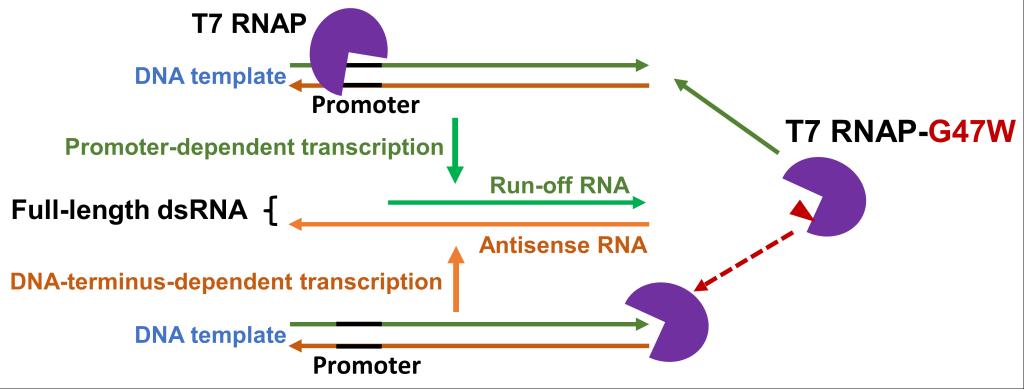
对mRNA药物疫苗影响最大的T7 RNA聚合酶转录副产物当属双链RNA(dsRNA)。dsRNA尤其是长dsRNA模拟病毒基因组信号,即使微量也会引起强烈的细胞免疫排斥效应,造成mRNA细胞毒性。业界目前普遍认为dsRNA来源于T7 RNA聚合酶的RNA依赖的RNA聚合酶(RdRp)活性,即以单链RNA自身为模版复制dsRNA。朱斌课题组前期报道的T7 RNA聚合酶S43Y突变体可有效降低T7 RNA聚合酶的RdRp活性以减弱这一来源的dsRNA。但在多项相关研究中,课题组发现T7 RNA聚合酶的RdRp延伸性有限,只能合成很短的dsRNA,无法说明长dsRNA的产生机制。
本工作对细胞毒性效应最大的全长dsRNA的来源进行了详细研究,清晰展示了全长dsRNA的真正来源:T7 RNA聚合酶会在没有启动子的的DNA末端开始转录,一般从倒数第二个碱基位置开始合成与目标RNA完全互补的反向RNA,反向RNA进而与目标RNA形成完全配对的全长dsRNA。DNA模版最末端的序列对全长dsRNA的产量有较大影响。作者比较了各类单亚基RNA聚合酶的DNA末端起始转录的情况,发现在已鉴定噬菌体单亚基RNA聚合酶中只有KP34和VSW-3 RNA聚合酶缺乏DNA末端起始能力,因此检测不到其产生的全长dsRNA。进而根据前期研究经验和不同酶之间的比较,朱斌课题组分析了T7 RNA聚合酶多种C-helix突变体的DNA末端结合和起始转录能力,发现G47W突变可显著降低T7 RNA聚合酶对DNA末端的结合,因而可以最有效减少全长dsRNA的产生。美国Moderna公司近期报道的G47A+884G突变体可有效减少RdRp引起的dsRNA,但在合成长链RNA时或在高产条件下该突变体的RNA产量显著降低。相比之下,G47W突变对蛋白质表达纯化及RNA合成产量均无显著影响,完全适配当前野生型T7 RNA聚合酶的标准反应和配套条件,是降低全长dsRNA最简单有效的方法。
8797威尼斯老品牌博士研究生余兵兵与陈逸凡为论文共同第一作者,8797威尼斯老品牌为论文唯一单位,8797威尼斯老品牌朱斌教授为通讯作者。本研究受到国家自然科学基金原创探索项目和生物医学峰基金支持。