(通讯员 冯崇宁)阐明运动发生所需神经环路及其分子机制对研究和治疗运动障碍疾病至关重要。
1月23日,8797威尼斯老品牌高尚邦研究组在eLife杂志上发表了题为“Excitatory motor neurons are local oscillators for backward locomotion”的研究论文(下图1),揭示兴奋性运动神经元可作为节律振荡器,驱动后退运动发生;同时阐明该节律震荡活性依赖高电压激活的钙离子通道UNC-2;神经环路上,上游运动前中间神经元AVA通过化学突触和电突触双向调控A运动神经元,控制后退运动的发生与维持。该研究成果为运动神经环路相关疾病的预防、治疗和药物开发奠定了理论基础。
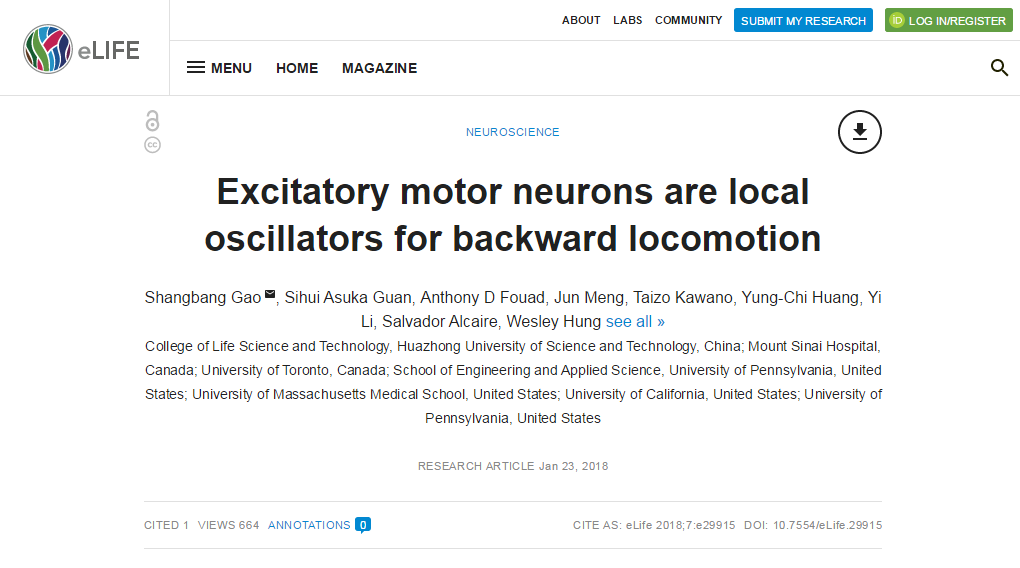
图1 eLife刊文
运动是动物维系个体生存和种族繁衍的最基本功能之一。随着我国全面小康社会的建设,运动障碍疾病越来越多的出现在日常生活中,给患者和家属带来沉重的经济和心理负担(下图2)。阐明运动产生和调控的生理、分子机制是预防运动障碍疾病的有效手段,是开发运动疾病治疗药物的基本前提。

图2 运动障碍疾病严重后果
高尚邦研究组以秀丽隐杆线虫(C. elegans,以下简称线虫)作为研究对象,研究运动产生、维持和调控的神经环路与分子机制)。线虫运动神经环路包括:两类中间神经元(包括AVB、PVC;AVA、AVD、AVE五对中间神经元);五类腹侧神经索(Ventral Nerve Cord,VNC)运动神经元(包括21个A神经元、18个B神经元、19个D神经元、6个VC神经元以及11个AS神经元); 95个对称分布在体壁的肌肉细胞。实验室之前的研究【1】发现,短时间(1秒)刺激运动前中间神经元AVA,运动神经环路产生持续的节律性电活性,该电活性直接驱动线虫作连续的后退运动。但记录到的节律性电活性到底是在运动神经环路中的哪类神经元上产生的?如何产生?需要什么分子机制等,全然未知。
高尚邦课题组与加拿大多伦多大学Lunenfeld-Tanenbaum Research Institute Mei Zhen教授实验室合作,利用一个光敏感杀伤蛋白miniSOG 【2】,特异杀死运动神经环路中不同组分神经元,发现,去除所有中间神经元和兴奋性B运动神经元后(只剩下兴奋性A运动神经元和抑制性D运动神经元),线虫仍然有效执行后退运动,提示兴奋性运动神经元能够单独支配运动的发生(下图3),该实验结论与我们了解的一般动物(特别是哺乳动物)运动发生需要中间神经元产生中央节律发生器CPG活性完全不同,线虫运动发生需要运动神经元而非中间神经元。该研究结论在前期研究结果的基础上,进一步明确了运动发生的神经环路机制。
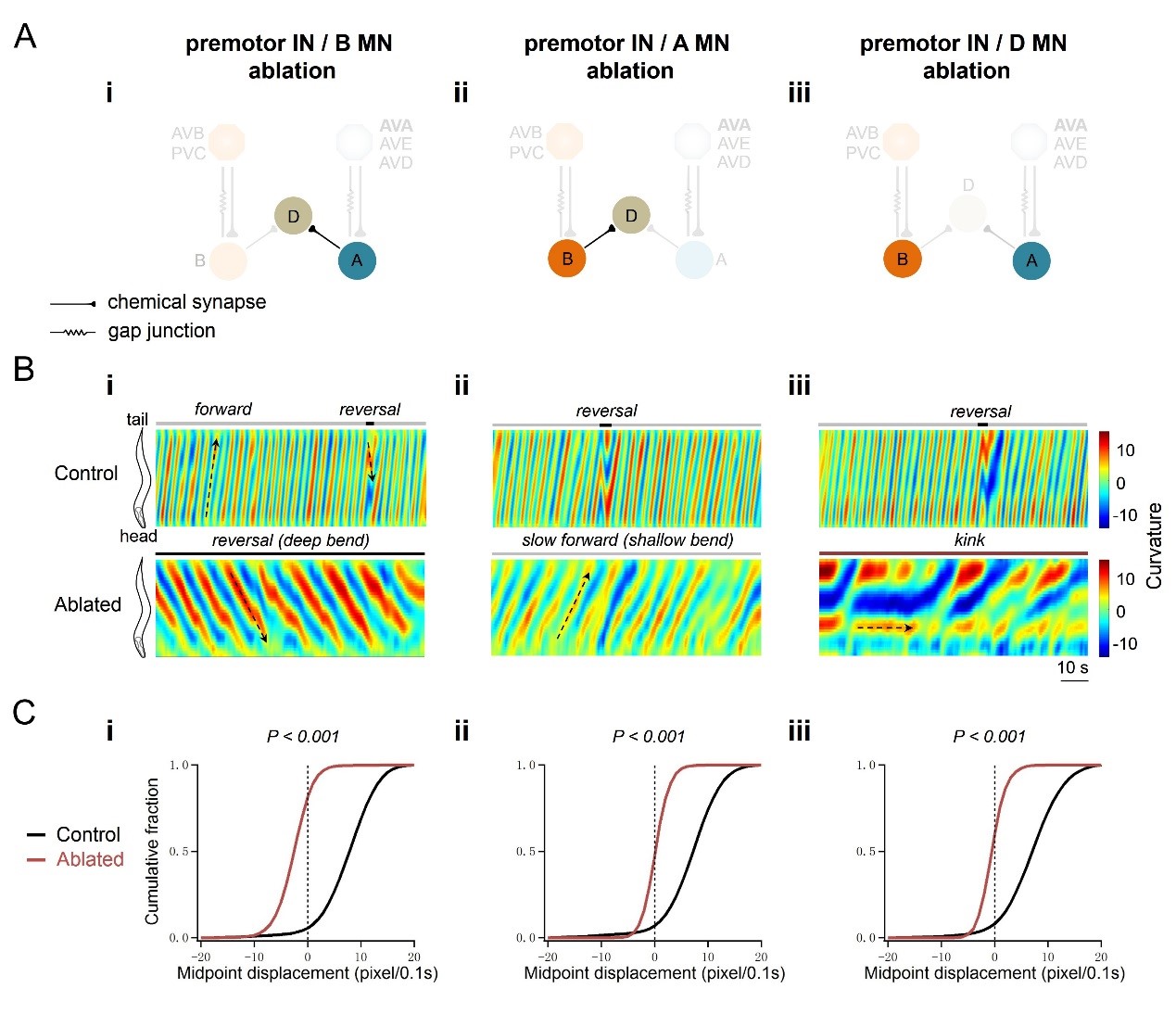
图3 A运动神经元产生后退运动
实验室人员利用在体胞内钙成像检测技术,发现,去除所有中间神经元和兴奋性B运动神经元后,A神经元能够产生自发的节律性的钙震荡,钙震荡周期与线虫后退运动正相关。在unc-2(lf)功能缺失突变体线虫中,相同操作后的钙震荡活性显著减弱,同时后退运动速率明显变慢。有趣的是,研究组还筛选出了一类功能增强的unc-2(gf)突变体等位基因hp647。在该突变体中,去除所有中间神经元和兴奋性B运动神经元后,A神经元节律性钙震荡频率显著增强,同时后退运动速率明显变快。
基于微小神经环路在体解剖技术和电生理膜片钳联合检测技术,研究人员进一步确认了这一结论。他们发现,去除所有中间神经元和兴奋性B运动神经元后,在线虫神经肌肉接头(运动神经环路终端输出组织)记录到周期为90秒左右的强烈节律电信号。当去除A神经元后(而不是其它神经元),该节律电信号消失,提示A运动神经元是信号产生源。进一步研究发现,节律电信号在unc-2(lf)线虫中减弱,在unc-2(gf)突变体中增强 (下图4)。
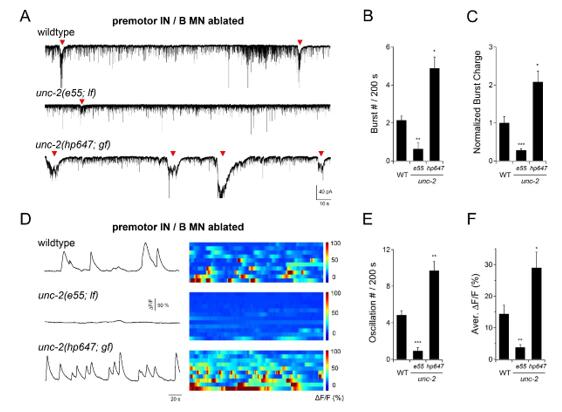
图4 UNC-2调控A神经节律震荡活性
为了进一步探索运动调控的神经环路机制,高尚邦和Mei Zhen研究组将光遗传蛋白ChR2表达到运动前中间神经元AVA中,发现光照AVA能够明显驱动后退运动,并引起A神经元的纪律性电活性发放,该电活性主要受AVA-A之间的化学突触传导。之前研究发现AVA-A之间有功能性电突触连接【3,4】,研究人员发现在在不杀死任何神经元的情况下,A神经元自发节律活性较弱,但在电突触连接蛋白unc-7(lf)线虫中,A神经元自发节律活性显著增强,提示AVA-A电突触连接的功能之一是抑制兴奋性A运动神经元,导致线虫总是偏向于向前运动。
该研究论文从神经环路功能机制上解析了A运动神经元依靠UNC-2产生自发节律震荡活性,控制后退运动的新调控机制(下图5)。
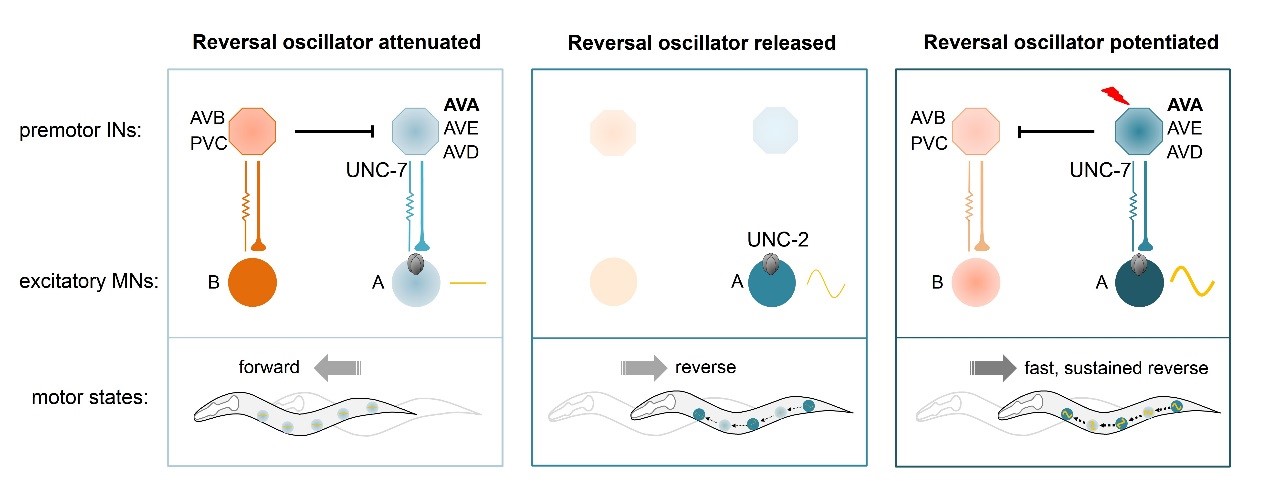
图5 线虫运动神经环路与分子调控机制示意图
eLife杂志受世界三大著名基金会(美国Howard Hughes Medical Institute,德国Max Planck Society和英国Wellcome Trust)联合资助。8797威尼斯老品牌高尚邦博士和加拿大多伦多大学Lunenfeld-Tanenbaum Research Institute Mei Zhen博士为本论文的共同通讯作者。8797威尼斯老品牌为第一通讯单位。该研究工作获得了国家计划青年项目、国家自然科学基金和武汉市青年科技晨光计划基金的资助。
高尚邦教授热烈欢迎优秀博士研究生、硕士研究生报考该实验室,常年招聘优秀博士后,欢迎有志于神经功能研究的本科生加入实验室学习。
参考文献:
1. Gao S, Xie L, Kawano T, Po MD, Guan S, Zhen M, Pirri JK, Alkema MJ. 2015. The NCA sodium leak channel is required for persistent motor circuit activity that sustains locomotion. Nature Communications 6:6323.
2. Qi YB, Garren EJ, Shu X, Tsien RY, Jin Y. 2012. Photo-inducible cell ablation in Caenorhabditis elegans using the genetically encoded singlet oxygen generating protein miniSOG. PNAS 109:7499–7504.
3. Kawano T, Po MD, Gao S, Leung G, Ryu WS, Zhen M. 2011. An imbalancing act: gap junctions reduce the backward motor circuit activity to bias C. elegans for forward locomotion. Neuron 72:572–586.
4. Liu P, Chen B, Mailler R, Wang ZW. 2017. Antidromic-rectifying gap junctions amplify chemical transmission at functionally mixed electrical-chemical synapses. Nature Communications 8:14818.